Travaux dirigés Chimie fiche 2 (chimie organique)
FICHE DE TD CHIMIE ORGANIQUE PCD
EVALUATION DES SAVOIRS
1. Complétez et équilibrez la réaction chimique suivante en donnant la formule développée et le nom du produit obtenu.
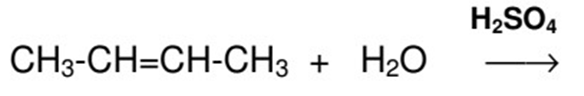
2. L’odeur de fromage est due à une molécule linéaire de masse molaire M = 86 (g/mol) comportant deux fonctions cétone.
2.1. Proposer une formule (semi-)développée pour cette molécule.
2.2. Suggérer un nom pour cette molécule.
3. Ecrire les formules développées des composés suivants :
a) pentan-2,4-dione b) 1-phénylbutan-2-one c) 2,2-dibromohexanal
4. Ecrire les formules semi-développées des composés suivants :
a) 2,4,4-triméthylpentan-2-ol b) 3-propylcyclohexan-1-ol c) pentan-2,3-diol
d) 3-bromophénol e) tricyclopropylméthanol f) 3,7-diméthyloct-6-èn-1-ol
5.1. Nommer les composés suivants :
Donner la formule semi-developpées des composés suivants :
a) 1,3-dichloro-3-méthylhexane b) (Z) hex-2-ène c) 2,2-diméthylhex-3-yne
d) 2,3-dim éthylpentan-2-ol e) 3,4,5-triéthyloctane.
EVALUATION DES SAVOIRS-FAIRE
Exercice I.
On introduit dans un eudiomètre 12 cm3 d’un mélange de propane et de 2–méthyl propane. On ajoute 100 cm3 d’oxygène et on provoque la combustion complète en faisant jaillir une étincelle. Après retour aux conditions initiales, l’eau s’étant condensée, il reste 42 cm3 de dioxyde de carbone et 31 cm3 d’oxygène.
1.1. Donner les formules semi-développées des deux alcanes.
1.2. Écrire l’équation bilan de la combustion de chaque alcane.
1.3. Exprimer en fonction des volumes des hydrocarbures, le volume total de dioxyde de carbone produit au cours de la combustion.
1.4. Déterminer la composition du mélange (en volume)
Exercice 2
La combustion d’un litre d’alcane gazeux donne trois litres de dioxyde de carbone.
|
|
2. 2. En déduire la formule de cet alcane et son nom.
Exercice 3 :
Un hydrocarbure gazeux A décolore l’eau de brome. Sa densité par rapport à l’air vaut 2.4.
3. 1. En déduire sa masse molaire et sa formule brute.
3.2. Ecrire les formules semi- développées et donner les noms de ces 6 isomères.
3.3. L’hydratation de l’un des isomères B possédant une chaîne linéaire, de ce composé où la double liaison est en position 1, donne deux produits, un majoritaire et un minoritaire.
a) Quelle règle permet de choisir le produit majoritaire ? Donner les deux produits et dite lequel est majoritaire.
b) Donner l’équation de polymérisation de B.
Exercice 4 :
On prépare le méthane au laboratoire par action de l’eau sur le carbure d’aluminium.
4.1. Ecrire l’équation bilan de cette réaction.
4.2. Par action de l’eau sur 100g d’Al4C3, on obtient 44.8 L de méthane
a) Calculer la masse de pur d’Al4C3 nécessaire à l’obtention de ce volume de méthane.
b) En déduire que le carbure d’aluminium utilisé renferme des impuretés.
c) Calculer le pourcentage des impuretés que renferme ce carbure.
4.3. Tout le méthane obtenu est placé dans une éprouvette contenant du di chlore, l’ensemble est versé dans une cuve contenant de l’eau salée et exposé à la lumière.
a) Pourquoi utilise-t-on de l’eau salée ?
b) Pourquoi cette eau
devient-elle acide ?
c) Donner les formules brutes ainsi que les noms des dérivés halogénés obtenus.
Exercice 5 :
Le produit A est un puissant insecticide (voir molécule).
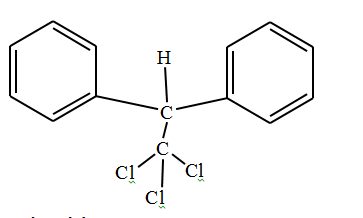
5.1- Donner le nom du composé A
5.2- Est-ce un composé aromatique ?
5.3- Déterminer sa masse molaire ainsi que son pourcentage en masse de chlore.
5.4- Le produit A est interdit dans de nombreux pays car il est mortel, une dose de 5g par Kg peut tuer l’homme. Quelle masse de A peut entraîner la mort d’un homme de 75Kg ?
Exercice 6 :
On envoie 1g de benzène vapeur avec du dihydrogène sur un catalyseur d’hydrogénation. Le produit obtenu est brûlé avec un excès d’oxygène et on obtient 1g de vapeur d’eau et du dioxyde de carbone.
6.1. Calculer la masse de dioxyde de carbone obtenu.
6.2. Calculer la masse de benzène ayant réagi avec le dihydrogène.
6.3. Calculer le rendement de la réaction d’hydrogénation.
Exercice 7 :
En faisant réagir, dans des conditions appropriées du dichlore sur 156g de benzène, on obtient 294g d’un composé qui se solidifie à la température ordinaire et un gaz qui donne des fumées blanchâtres en présence de gaz ammoniac.
a. Déterminer la formule du composé obtenu et écrire l’équation de la réaction mise en jeu.
b. Donner la structure et le nom des isomères répondant à la formule déterminée.
Exercice 8:
8.1. Un alcène a pour formule brute C4H8. Ecrire les formules semi-développées des isomères possibles.
8.2. On dispose un de ces isomères afin de l'identifier, on réalise son hydratation.
Donner la formule du (ou des) alcool(s) susceptible(s) d'être obtenu(s) à partir de chaque isomère.
Préciser la classe de chacun de ces alcools.
8.3. L'expérience montre que l'on obtient deux alcools A et B de classes différentes ; que peut-on déduire de ce renseignement?
Exercice 9
Les automobilistes utilisent les essences comme carburant. Soit un carburant supposé formé d'heptane pur.
9.1) Ecrire la formule semi-developpée de l'heptane
9.2) Ecrire l'équation-bilan de sa combustion complète
9.3) La densité de l'heptane est d = 0,68. On considère le réservoir d'une automobile contenant
45L de carburant.
9.3.1) Quel volume d'air faut-il pour la combustion complète de toute l'essence contenue dans le réservoir?
9.3.2) Quel est le volume de dioxyde de carbone rejeté dans l'atmosphère ? N.B : Tous les volumes sont mesurés dans les conditions normales de température et de pression.
9.4) Le pouvoir calorifique de l'heptane est d'environ 46000kJ/kg. Le rendement du moteur de l'automobile est de 25%.
9.4.1) Quelle quantité d'énergie est utilisée à la propulsion du véhicule?
9.4.2) Quelle quantité d'énergie sert à chauffer l'atmosphère lors de la combustion complète de l'essence du réservoir? On donne : eau 1000kg /m3
Exercice 10 : Mr Mbock décide de réaliser la polymérisation du styrène de formule
10.1) Quel autre nom utilise-t-on pour désigner le styrène? :
10.2) Qu'appelle-t-on polymérisation?
10.3) Quels sont le nom et le motif du polymère obtenu?
10.4 Ecrire l'équation bilan de cette polymérisation.
10.5) Déterminer l'indice de polymérisation de cette réaction sachant que la masse molaire de la macromolécule obtenue est: M = 8320g.mol-1.
Exercice 11: étude du carbinol
Le carbinol appelé couramment méthanol est un alcool gazeux toxique de formule CxHyO ; sa densité de vapeur par rapport à l’air est d=1,1.
L’analyse quantitative d’un échantillon de ce composé nous donne : %C= 32,045 ; %H= 37,450.
11.1 Déterminer les masses approximatives de carbone, d’hydrogène et d’oxygène. 11.2. Déduire la formule brute du Carbinol
Exercice 12:
L'analyse d'un composé S de masse 1,16 g constitué de carbone, d'hydrogène et d'oxygène a donné les résultats suivants:
- Augmentation de masse des tubes à potasse: 2,64 g,
- Augmentation de masse des tubes à ponce sulfurique: 1,08 g.
La densité de vapeur du composé S est d = 2,00.
12.1. Déterminer la composition centésimale massique du composé.
12.2. Trouver sa formule brute.
12.3. Trouver sa formule semi-développée sachant qu'il réagit avec le réactif de Schiff.
Exercice 13 : (les parties a, b, c et d sont indépendantes).
A- La densité d’un composé organique oxygéné de formule brute CxHyOz est de d = 2,48 Sa composition centésimale massique est de C = 66,6% et de O = 22,2%. 1- Calculer sa masse molaire puis l’exprimer en fonction de x, y et z.
2- Identifier x, y et z puis donner la formule brute du composé.
B- L’oxydation de 3,6g d’aspirine ou d’acide acétylsalicylique produit 7,92g de substance absorbable par la potasse et 1,44g de substance absorbable par l’acide sulfurique concentré.
3- Déterminer la composition centésimale massique de l’aspirine sachant qu’il est uniquement constitué des éléments Carbone, Oxygène et Hydrogène.
C- Un hydrocarbure a pour formule CnH2n+2 et a pour composition massique centésimale 82,76% de carbone et 17,24% d’hydrogène.
4- Déterminer sa formule brute.
5- Ecrire les deux formules sémi-développées de ce composé sachant que le carbone est tétravalent et l’hydrogène est monovalent.
D- La nitroglycérine est un composé organique de formule C3H5O9N3 qui se décompose au moindre choc .La réaction qui se produit est très exothermique et elle produit du dioxyde de carbone, de l’eau sous forme de liquide, du diazote et du dioxygène.
6- Ecrire l’équation bilan de la réaction de décomposition de ce composé. Déterminer le volume gazeux total libéré par décomposition de 12g de ce composé dans les conditions ou le volume molaire vaut Vm = 25L/mol. On donne: MC=12g/mol; MH=1g/mol; MO=16g/mol; MH = 14 g/mol
EVALUATION DES COMPETENCES
Competence 1 : Préparation du TNT
Amougou élève en classe de 1ère C après avoir assimilé le cours de chimie sur les composés aromatiques, décide de fabriquer des mini explosifs (« badjeur » pétard utilisé pendant les fêtes de Noel comme divertissement) Il se rend dans un supermarché de la ville pour s’acheter le nécessaire.
- Tache 1 : Qu’est-ce qu’Amougou devra prévoir sur sa liste afin de mener à bien son œuvre sachant qu’il voudrait fabriquer du TNT, et qu’il ne pourra pas profiter du nécessaire se trouvant dans le laboratoire de Chimie de son collège ?
- Tache 2. Décrire brièvement le mode opératoire puis Ecrire les équations des réactions qui ont lieu pendant la préparation.
- Tache3 : En utilisant 3L de benzène pour cette préparation, Calculer la masse approximative du trinitrotoluène obtenu sachant que le benzène n’est pur qu’à 90%
Compétence 2
|
Proposé par M. ELONA ALEGUE JOEL
|
- Tache 1 : Apres avoir déterminé la formule brute de cet alcane, déduire son nom.
- Tache 2 : Combien d’isomères possède-t-il ?
- Tache 3 : Calculer la masse et le volume d'alcane gazeux consommés par ce moteur au cours d'un cycle moteur.
Compétence 3
- Tache 1 : A quoi sert-il ?
La production maximale journalière de cette usine est de 850kg de lindane. Sachant que cette préparation se fait toujours dans des conditions où le volume molaire vaut 24L.mol-1,
- Tache 2 : Quel est le volume du dichlore consommé par cette usine en une année.
- Tache3 : L’année suivante, la chaîne de production baisse de performance et enregistre des pertes de l'ordre de 12%. Quelle quantité supplémentaire de dichlore devrait utiliser cette usine pour obtenir la même production annuelle que l'année précédente ?
Compétence 4 : Au cours d'une substitution, si un atome H du benzène est remplacé par un groupe méthyle – CH3, les substitutions suivantes seront orientées vers les positions ortho et para.
- Tache1 : Ecrire les équations-bilan des nitrations du méthylbenzène (toluène) qui conduisent aux dérivés mono-, di- et tri-nitrés.
- Tache 2 : Donner le nom de chacun des dérivés obtenus.
- Tache 3 : Quelle est la masse de trinitrotoluène (TNT) obtenu à partir de 100L de toluène, si le rendement de la réaction est de 100%. NB: La densité du toluène liquide est 0,866.
Compétence 5 : étude du tramadol
Ngono pose la question à son enseignant de chimie ce qu’est le tramol dont il entend parler depuis pas mal de temps déjà avec insistance ? Le tramol encore appelé tramadol est un antalgique central. Depuis 2011, il fait partie de la liste des médicaments à surveiller au Cameroun. La prise du tramadol ou tramol entraine beaucoup d’effet secondaire indésirables que sont : nausées, céphalées, vertiges, hypoglycémie, anxiétés, dépression, crise d’angoisse, et beaucoup de dysfonctionnement sexuelles telles la baisses de la libido, l’anorgasmie et bien d’autres. Son enseignant l’invite au labo du lycée afin de déterminer sa formule brute. En soumettant 1,800g de tramadol à l’analyse quantitative élémentaire, ils recueillent 4,818g d’un composé absorbable par les tubes à potasse, 1,540g d’un composé absorbable par les tubes à ponces sulfuriques et 0,116g d’un composé qui fait virer au marron le réactif de Nessler.
- Tache 1 : Quels sont les composés absorbables respectivement par les tubes à potasse et les tubes à ponces sulfuriques ?
- Tache2 : Sachant que l’ammoniac fait virer au marron le réactif de Nessler, déterminer le pourcentage en masse des éléments carbone, hydrogène et azote contenus dans le tramadol.
- Tache 3 : En justifiant si le tramadol contient-il de l’oxygène ou pas, déterminer sa formule brute du sachant que sa masse molaire moléculaire est de 263g.mol-1
Exercice 6 : Identification d’un alcool
Kamdem et Bouba sont deux élèves en candidat au probatoire ESG. Punis par leur professeur de chimie pour bavardage, ce dernier les envoie nettoyer le labo de PCT du lycée pendant toute la durée du cours. Une heure de temps après Bouba et kamdem ont terminer, et voulant mettre à profit les unes heures restantes, décident d’identifier un alcool pris au hasard dans l’armoire du labo. Ils le déshydratent, et obtiennent un alcène gazeux. La combustion complète de 10 mL de l'alcène, réalisée en présence de dioxygène dans un eudiomètre produit 30 mL de dioxyde de carbone, les volumes étant mesurés dans les mêmes conditions de température et de pression.
- Tache 1 : En utilisant les informations ci-dessus, aidez-les à trouver la formule brute correspondante à cette alcool. Peuvent-il déjà l’identifier ? Si non pourquoi ?
Cette alcool subit ensuite une oxydation ménagée par le dichromate de potassium en milieu acide. Le produit principal de l'oxydation réagit avec la DNPH d'une part, et avec la liqueur de Fehling d'autre part.
- Tache 2 : Quelle différence fondamentale existe il entre le produit de réaction issu de la DNPH par rapport à celle issu de la liqueur de Fehling.
- Tache 3 : Kamdem pense que seule le test positif à la DNPH est nécessaire à l’identification de l’alcool, alors que Bouba pense plutôt au test positif à la liqueur de Fehling. En disant qui des deux a raison, représenter la formule semi développée de cette alcool.