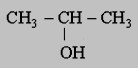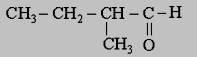Travaux dirigés ficge 5 (Les composés organiques)
TD SUR LES COMPOSES OXYGENES
PARTIE A Évaluation des ressources
Exercice 1 : Évaluation des savoirs
1/Définir, donner les fonctions chimiques et les formules générales des composés suivants:
Alcool; Aldéhyde; Cétone; Acide carboxylique
2/Énonce la règle de Markov-nikov
3/Quel est le but principal de l’oxydation ménagée des Alcool?
Exercice 2 :
Déterminer la F.S.D, le nom et la classe de chaque isomère de C5H11OH.
Exercice 3 :
L’analyse élémentaire d’un composé (A) a donné 62% de carbone , 27.6% d’oxygène et 10.4% d’hydrogène.
1/ Sachant que la masse molaire de (A) est égale à 58g.mol-1, déterminer la formule brute de (A).
2/ Donner la formule semi-développée et le nom de chaque isomère répondant à la formule brute de (A).
3/ Le composé (A) réagit avec le réactif de Schiff. Identifier (A).
4/ Comment peut-on préparer (A) à partir d’un alcool (B).
5/ L’isomère (B’) de (B) subit une oxydation ménagée par l’oxygène de l’air.
|
|
ÉVALUATION DES SAVOIRS-FAIRE
Exercice 1 :
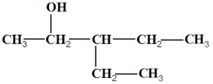
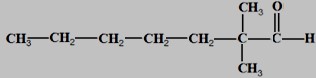
1- On dispose de trois alcools A1 ; A2 et A3 de formules semi développées respectives :
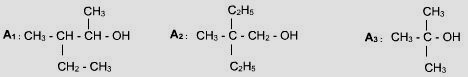
Exercice 2:
1- Donner le nom et la classe de chaque alcool.
2- On a réalisé l’oxydation ménagée de l’un des alcools précédents par une solution acidulée de permanganate de potassium (K+ + MnO4-), le produit formé a donné un précipité jaune avec la D.N.P.H et n’a pas réagi avec le réactif de schiff.
a- Préciser, en le justifiant, l’alcool utilisé.
b- b- Décrire la réaction et écrire l’équation (ou les équations) de la réaction (ou des réactions) qui s’est (ou qui ont été) produite(s). Donner le nom et la famille du (ou des) produit(s) formé(s).
3- La déshydratation intramoléculaire de l’alcool A3 a donné un composé (C).
a- Donner le nom et la famille de (C)
Exercices de synthèse :
4. Etude du composé B a- Déterminer la formule brute de B.
b- Pour préciser la structure de B, on effectue une oxydation ménagée qui conduit à la formation d'un composé C . Puis on soumet C aux tests suivants :
-une solution de C additionnée de DNPH conduit à la formation d'un précipité de couleur jaune.
- une solution de C additionnée Au réactif de schiff ne provoque aucun changement de couleur. Déduire de ces expériences les formules semi développées et les noms de C et de B.
Exercice 2:
Un composé organique de formule brute CnH2nO2 contient 27,6% d'oxygène en masse.
1. Montrer que la molécule correspondant à ce composé comporte 6 atomes de carbone. Calculer sa masse molaire.
2. Ce composé est un ester naturel possédant une odeur agréable .On le note E .Par hydrolyse de E, on obtient deux corps désignés par A et B. a- Quelles sont les deux fonctions chimiques de ces deux corps.
b- Parmi les termes suivants, indiquer ceux qui conviennent pour caractériser une réaction d'hydrolyse: complète, limitée, totale, aboutissant à un équilibre chimique, dépend du catalyseur.
3. Étude du composé A.
Sachant que la formule brute de A est C2H4O2 ; et que sa solution aqueuse fait virer le bleu de bromothymol du vert au jaune. a- Déterminer la formule semi-développée et le nom de A.
b- Ecrire l’équation de son ionisation dans l’eau.
5. a- Donner la formule semi développée de E.
b- Ecrire l’équation de l’hydrolyse de E.
PARTIE B : AGIR COMPETENTS
Exercice 3: Utilisation des acquis
Un composé A donne un précipité avec la DNPH et décolore l’ion permanganate en milieu acide pour former un corps B.
1.1 -A quelle famille appartient le corps A.
1.2 Écrire l’équation de la décoloration de l’ion permanganate par A
1- 0,44g de A sont oxydés exactement par 80ml de l’ion permanganate de concentration 0,05mol/L. Déduire la formule semi développée de A et celle de B.
2- On fait réagir en présence de H2SO4 concentré 6g de corps B avec 7,4g d’un corps C. On obtient un ester E dont la formule brute est C6H12O2.
4.1 En déduire la fonction chimique et la formule brute de C.
Écrire l’équation de la réaction de B avec C. Quelles sont les caractéristiques de cette réaction ?
4.2 Donner tous les isomères de E en précisant leurs noms.
4.3 Sachant qu’à l’équilibre, il reste 0,033mole d’acide, calculer le nombre de mole d’ester formé ainsi que le pourcentage d’estérification. Quelle formule semi développée faut-il retenir pour E.
Exercice 2:
Compléter le tableau suivant:
|
NOM
|
FORMULE
|
FAMILLE
|
|
Propan-2-ol
|
|
Alcool
secondaire
|
|
|
|
Aldéhyde
|
|
2-méthylpentan-3-one
|
|
|
|
|
|
Alcool primaire |
|
Acide 3-méthylbutanoïque
|
|
Acide
carboxylique |
|
|
|
|
|
3-éthylpentan-2-ol
|
|
|
|
Butanone
|
|
Cétone
|
|
Acide 2-méthylpropanoïque
|
|
Acide
carboxylique
|
|
hexan-3-one
|
|
|
|
|
|
Aldéhyde
|
|
3-méthylbutan-1-ol
|
|
Alcool primaire
|
Exercice 4: Exercice à caractère expérimentale
On étudie expérimentalement la réaction d’estérification de l’acide éthanoïque par l’éthanol. On prépare dans un ballon un mélange équimolaire d’acide et d’alcool. A une date t=0, ce ballon est placé dans un bain marie porté à 80°C.
1°/ Ecrire l’équation de la réaction.
2°/En cours de réaction, à intervalles de temps réguliers, on a prélevé dans le mélange réactionnel de très petits échantillons de volume V connu, que l’on a refroidit puis dosé avec une solution d’hydroxyde de sodium de concentration molaire CB =2mol.L-1 en présence de phénolphtaléine. On peut ainsi connaître l’évolution du nombre de mole nA de l’acide éthanoïque dans le mélange réactionnel au cours du temps ce qui nous a permis de tracer la courbe de nA = f(t) (Voir figure ci-dessus). a- Représenter un schéma annoté du matériel utilisé au cours du dosage.
b- Comment peut-on détecter la fin
du dosage ?
TRAVAUX DIRIGES SUR LE BENZENE
Exercice 1 :
Ecrire tous les isomères aromatiques du diméthylbenzène. Donner leurs noms en nomenclature officielle. En déduire les isomères de tétraméthylbenzène, et les nommer.
Exercice 2 :
Donner la formule semi développée des composés suivants : a- 1-éthyl 2-méthylbenzène ; b- para diméthylbenzène ; c- ortho dipropylbenzène ; d- 1-bromo 2,6dinitrobenzène ; e- para dinitrobenzène ; f- 2,4,6-trinitrotoluène; g- ortho dinitrostyrène ; h- 1,2,5trichlorobenzène
Exercice 3 :
1-Quel est l’hydrocarbure aromatique dont la masse molaire vaut 92 g.mol-1. Quel est son nom ?
2-Un hydrocarbure de masse molaire 106 g.mol-1 possède un noyau aromatique. Déterminer sa formule brute et les formules semi développées possibles.

Exercice 4 :
Les hydrocarbures benzéniques sont caractérisés par la présence d’un noyau benzénique dans leur chaîne
sur la molécule de benzène. Ecrire la formule générale et les isomères des carbures benzéniques dont la formule moléculaire comprend huit atomes de carbone.
Exercice 5 :
Un composé A, de formule brute C8H8, possède les propriétés suivantes :
-A se nitre facilement.
-A décolore l’eau de brome sans catalyseur.
-A donne, par hydrogénation, un composé de formule brute C8H16 qui ne présente aucune des propriétés précédentes. En déduire la formule semi développée de A.
Exercice 6:
Un composé A, de formule brute C14H10, possède deux noyaux benzéniques sans coté communs. Soumis à une hydrogénation catalytique sur palladium désactivé, A fournit l’hydrocarbure B de formule C14H12. B peut, à son tour, être hydrogéné à la température et à la pression ordinaire, sur nickel divisé : on obtient un corps C de formule C14H14. C, soumis à une hydrogénation sur platine, à température et pression élevées, conduit à un hydrocarbure D de formule C14H26. Lorsque, par ailleurs, l’hydrocarbure C est placé à la lumière en présence de dichlore, il donne naissance à un produit mono chloré unique E et à un dégagement de chlorure d’hydrogène.
1-En déduire la formule semi développée de chacun des composés A, B, C, D et E.
2-Sachant que l’hydrogénation catalytique, sur palladium désactivé, du but-2-yne conduit exclusivement au but-2-ène-Z et que ce résultat est généralisable, en déduire la nature Z ou E des composés A, B, C ou D si elle existe.
3-Ecrire les équations bilan de toutes les réactions. Préciser s’il s’agit d’une addition ou d’une substitution.
Exercice 7:
En faisant réagir, dans des conditions appropriées, du dichlore sur 7, 8 g de benzène, on obtient 8,8 g d’un composé, de masse molaire M = 147 g.mol-1, qui se solidifie à la température ordinaire, et un gaz dont la solution est acide.
1-Déterminer la formule du composé obtenu et écrire l’équation–bilan de la réaction.
2-Donner la formule semi développée et le nom des isomères répondant à la formule déterminée. 3-Calculer le rendement de la réaction.
Exercice 8 :
Un hydrocarbure A, a pour formule brute C9H12.
-Par hydrogénation, en présence d’un catalyseur, A donne un corps de formule C9H18.
-En présence de dibrome et de tri chlorure d’aluminium, A conduit à un produit de substitution B contenant
40,2% en masse de brome
1-Montrer que A renferme un noyau benzénique.
2-Montrer que le brome ne se substitue qu’une fois sur A.
3-Ecrire toutes les formules semi développées de A (8).
4-Il n’existe qu’un seul dérivé mono nitré de A. En déduire la formule semi développée de A.
Exercice 9 :
Un hydrocarbure A dont la masse molaire est voisine de 78g.mol-1 renferme en masse 92,3% de carbone.
1-Trouver la formule brute de ce composé.
2-Dans certaines conditions, ce composé réagit avec du dihydrogène pour donner du cyclohexane.
2.1-Nommer le corps A et donner sa formule semi développée.
2.2-Ecrire l’équation bilan de la réaction. De quel type de réaction s’agit-il ? 3-Quel volume de dihydrogène, mesuré dans les CNTP, faut-il utiliser au cours de la réaction si on utilise 19,5g du composé A ?
Exercice 10 :
Calculer la densité, par rapport à l’air, des vapeurs de benzène et de toluène. Où doit-on placer les bouches d’aération dans les locaux où l’on utilise ces composés ?
Exercice 11 :
Un hydrocarbure A de masse molaire MA=106g.mol-1 donne par hydrogénation un composé saturé B de masse molaire MB=112g.mol-1. Par ailleurs, B contient en masse 6 fois plus de carbone que d’hydrogène.
1-Déterminer les formules brutes de B et A.
2-Ecrire l’équation bilan traduisant l’hydrogénation de A en B.
3-Ecrire les formules semi développées possibles de A.
4-A donne par substitution avec le dichlore un composé C renfermant en masse 25,2% de chlore.
4.1-Déterminer la formule brute de C.
4.2-Ecrire l’équation bilan traduisant le passage de A à C.
Exercice 12:
1-On réalise la dinitration du benzène (obtention du dinitrobenzène). Ecrire la formule semi développée des composés susceptibles de se former.
2-On part de 50 g de benzène. Déterminer la masse d’ortho, para, méta dinitrobenzène obtenue (on suppose la réaction complète) sachant que leurs pourcentages dans le mélange sont : 7% pour l’ortho dinitrobenzène 93% pour le méta dinitrobenzène 0% pour le para dinitrobenzène.
Exercice 13 :
1-L’action du mélange sulfonitrique (H2SO4+ HNO3) sur du phénol donne un dérivé trinitré. Ecrire la
formule semi développée de ce dérivé.
2-On traite 9,4g de phénol par le mélange sulfonitrique. Quelle est la masse du produit obtenu, sachant que le rendement de la réaction est 80% ?
Exercice 14 :
1-Un alkyl benzène A de masse molaire MA=106 g.mol-1 peut être obtenu en faisant réagir un chlorure d’alkyle CnH2n+1Cl sur le benzène en présence de chlorure d’aluminium AlCl3 utilisé comme catalyseur.
1.1-Déterminer la formule semi développée de l’alkyl benzène A et celle du chlorure d’alkyle et les nommer.
1.2-Ecrire l’équation bilan de la réaction.
2-On réalise la chloration de A en présence de chlorure d’aluminium utilisé comme catalyseur. On obtient un composé aromatique B contenant en masse 25,3% de chlore (substitution en para et / ou ortho du groupe alkyle). Ecrire les formules semi développées des isomères de B et les nommer.
3-On réalise la mono nitration d’une masse m = 21,2 g de l’alkyl benzène en présence d’acide sulfurique
H2SO4 concentré. On obtient un composé aromatique C comportant un groupe nitro en position para du groupe alkyle.
3.1-Ecrire l’équation bilan de la réaction et nommer le produit C.
3.2-Déterminer la masse m’de produit C obtenu sachant que le rendement de la réaction est de 93%.
Exercice 15 :
1-Le xylène est le nom courant du diméthylbenzène. Combien a-t-il d’isomères ?
2-Le propène peut fixer une molécule de chlorure d’hydrogène.
2.1-Quelles sont les formules développées des deux produits que l’on peut obtenir ?
2. 2-En fait, on obtient un seul corps : le plus symétrique des deux. Donner son nom systématique.
3-Traité par le corps obtenu en 2-en présence de chlorure d’aluminium, le méta xylène donne une réaction de substitution au cours de laquelle un groupe isopropyl remplace un atome d’hydrogène du cycle benzénique.
3. 1-Combien d’isomères peut-on obtenir ?
3.2-Compte tenu de l’encombrement du groupe isopropyle, quel sera l’isomère le plus abondant ?
4-La nitration de cet isomère conduit à un produit dont la composition massique centésimale est la suivante : C : 46,6 % ; H : 4,6 % ; N : 14,8 % ; 33,9 %. Déterminer sa formule brute, sa masse molaire et sa formule développée.
Exercice 16 :
Un composé A, de formule brute C8H10, possède les propriétés suivantes : en présence de dibrome, et avec du fer, A donne un produit de substitution contenant 43% de dibrome ; par hydrogénation de A, en présence d’un catalyseur on obtient C8H16.
1-En déduire la nature du composé A. Montrer que l’action du dibrome sur A est une mono substitution. 2-Proposer les différentes formules semi développées de A. Montrer qu’il y en a quatre.
3-Afin de choisir et de préciser la formule semi développée de A, on effectue une déshydrogénation de A en B ; ce dernier composé a pour formule C8H8 et décolore l’eau de brome. Préciser alors la formule de B. 4-On indique B est le styrène. Préciser la formule de A.
5-Combien existe-il de dérivés mono bromés de A ( bromation sur le noyau aromatique) ? Ecrire leurs formules semi développées.